Leucémie myéloïde chronique (LMC) - Traitement

Ce sera probablement le médecin de famille – sur la base de l’hémogramme ou d’autres résultats d'examen anormaux – qui suspectera une LMC.
Pour un diagnostic précis et confirmé et pour surveiller le traitement, le médecin de famille fera appel à un spécialiste en cancérologie (oncologue). Une bonne collaboration entre le patient, le médecin de famille et le spécialiste sont la condition requise pour la réussite du traitement.
Les questions suivantes seront traitées plus en détail ci-dessous:
- Traitement médicamenteux
- Objectifs thérapeutiques
- Réponse au traitement – étapes clés dans le traitement par ITK
- Effets secondaires
- Greffe de cellules souches
- Médecine complémentaire
- Désir d’enfant
- Liste de contrôle pour l’entretien avec le médecin traitant
Traitement médicamenteux
Grâce à de médicaments très efficaces, il est aujourd’hui possible de tenir la LMC en échec pendant de nombreuses années et de procurer ainsi aux patients une bonne qualité de vie. Ceci est, pour la plupart des patients, l’objectif le plus important du traitement. Pour le réaliser, il importe de commencer le traitement très tôt et d'obtenir une réponse au traitement aussi complète et rapide que possible. Dans les directives thérapeutiques, une réponse optimale (voir aussi la partie suivante intitulée Réponse au traitement) est définie de la manière suivante:
- réponse hématologique complète au bout de 3 mois (normalisation de l’hémogramme)
- réponse cytogénétique complète au bout de 12 mois (le chromosome Philadelphie n’est plus détectable)
- très bonne réponse moléculaire au bout de 18 mois (moins de 0.1% des cellules contiennent la modification génétique BCR-ABL).
D’une manière fondamentale, on fait la distinction entre traitements de première intention (ou de première ligne) et traitements de deuxième intention (ou de deuxième ligne). Les traitements de première intention sont utilisés dans les maladies nouvellement diagnostiquées, tandis que les traitements de deuxième intention ne sont administrés qu'en cas d’efficacité insuffisante, voire d’échec du traitement de première intention.
Il y a quelques années encore, la LMC était surtout traitée avec des interférons, une substance produite à la base par le corps, et avec des chimiothérapies. Par la suite, les inhibiteurs de la tyrosine kinase se sont joints au traitement. Cette classe de médicaments freine la multiplication des cellules leucémique et peut ainsi agir sur la cause de la LMC.
En Suisse, il existe trois inhibiteurs de la tyrosine kinase qui sont autorisés comme traitement standard.
Objectifs thérapeutiques
Tout au long de la maladie, des analyses du sang et de la moelle sont effectuées afin de déterminer comment le traitement agit sur la multiplication des cellules leucémiques et la qualité de la formation des éléments figurés du sang. L’objectif de toute thérapie est non seulement l’élimination des cellules leucémiques dans le sang, mais aussi la disparition du chromosome Philadelphie et de la modification génétique BCR-ABL, si possible dans toutes les cellules.
On différencie donc entre les réponses hématologiques, cytogénétiques et moléculaires:
Réponse hématologique
Il s’agit de déterminer avec quelle efficacité le traitement agit sur l’hémogramme, c’est-à-dire sur la formation des globules blancs et rouges ainsi que sur les plaquettes sanguines.
|
A déterminer |
Valeur normale |
|---|---|
| Globules rouges (érythrocytes) | Femme: 3.5 à 5 millions par µl (microlitre) Homme: 4.3 à 5.9 millions par µl |
| Hémoglobine | Femme: 120 à 150 g/l Homme: 130 à 170 g/l |
| Leucocytes (globules blancs): | 3'200 à 9'800 par µl, dont 60 à 80 % sont des granulocytes |
| Thrombocytes (plaquettes sanguines) | 130'000 à 400'000 par µl |
Au stade chronique de la LMC, on constate avant tout une augmentation considérable du nombre de globules blancs, mais aussi une légère augmentation du taux des thrombocytes. L’effet du traitement peut ainsi être mesuré dans l’hémogramme, notamment par une diminution du nombre des leucocytes.
On parle d’une réponse hématologique complète lorsque l’hémogramme devient normal sous l’effet du traitement (leucocytes: moins de 10'0000 et thrombocytes: moins de 450'000 par µl). Si on constate une amélioration de l’hémogramme, mais non pas une normalisation, on parle de réponse partielle.
Le traitement peut faire chuter le nombre de plaquettes. Dans ce cas, il est parfois nécessaire d’interrompre temporairement le traitement ou d’adapter le dosage.
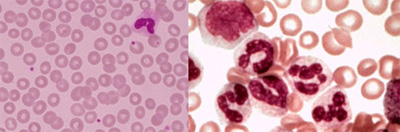
Réponse cytogénétique
L’examen de moelle osseuse a pour objet d’évaluer dans quelle mesure le traitement peut faire disparaître le chromosome Philadelphie dans les globules blancs. Si deux analyses microscopiques successives de la moelle osseuse ne mettent pas en évidence le chromosome Philadelphie, on estime que la réponse cytogénétique au traitement est complète.
Réponse moléculaire
L’examen du sang par PCR, une technique extrêmement sensible, permet de détecter même des quantités résiduelles infimes de cellules porteuses d’un gène BCR-ABL. Cette méthode est si précise que même un seul et unique gène BCR-ABL pourra être identifié parmi un million de cellules normales. On parle de bonne (réponse moléculaire majeure=MMR pour Major Molecular Response) réponse génétique moléculaire lorsque le paramètre BCR-ABL a atteint des valeurs inférieures à 0,1% lors de deux tests PCR successifs. Si cet objectif a pu être atteint grâce au traitement, on peut formuler un bon pronostic et espérer avec raison une durée de vie longue sans maladie. L’illustration ci-après décrit la méthode de la PCR.
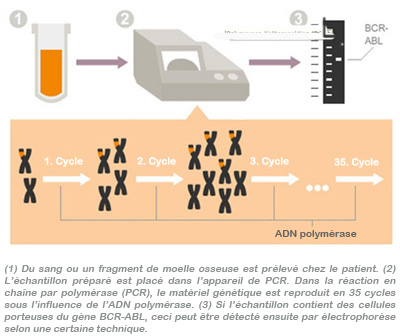
Le laboratoire effectuant l’analyse devrait, selon l’avis d’experts, avoir obtenu une certification attestant que les résultats de la PCR sont fournis selon les normes internationales.
Réponse au traitement – étapes clés dans le traitement par ITK
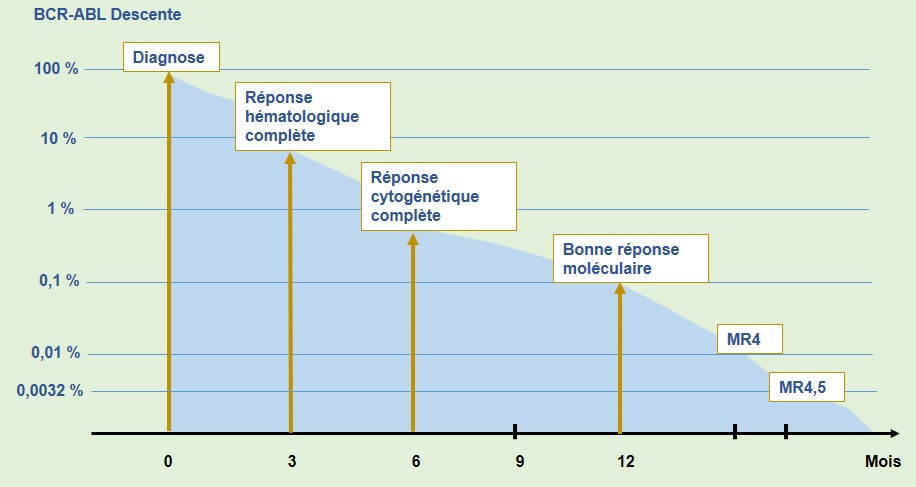
Lorsque le patient atteint les objectifs attendus, cela indique qu’il répond de manière optimale au traitement par ITK et a ainsi toutes les chances de vivre longtemps sans maladie et de conserver une espérance de vie normale. Dans ce contexte, une réponse moléculaire précoce et marquée est décisive. L’intensité de la réponse est reflétée par la valeur BCR-ABL, mesurée dans un échantillon sanguin à l’aide de la technique de la PCR (réaction en chaîne par polymérase).
La réponse des patients au traitement est très variable d’un individu à l’autre. De ce fait, il est donc tout à fait possible que l’un des objectifs ne soit pas toujours atteint dans le délai attendu. Néanmoins, cela ne signifie pas que le traitement soit inefficace. Si un objectif est manqué de peu, cela indique uniquement que, pour l’instant, le traitement doit être plus étroitement surveillé.
Sont visés les objectifs suivants
- Étape clé hématologique (hémogramme): une réponse hématologique complète doit être obtenue après 3 mois de traitement.
- Étapes clés cytogénétiques (chromosome Philadelphie): dans le cas idéeal une réponse cytogénétiqu complète est attendue après 6 mois de traitement.
- Étapes clés moléculaires (valeur BCR-ABL): il est question de réponse moléculaire optimale lorsque la valeur BCR-ABL atteint le seuil de 10% après 3 mois et le seuil de 0,1% après 12 mois de traitement. Atteindre le seuil de 0,1% est appelé «bonne réponse moléculaire» ou MMR (de l’anglais major molecular response) et constitue l’étape moléculaire la plus importante.
Certains patients répondent de manière plus prononcée encore, c’est-à-dire qu’ils atteignent des valeurs de BRC-ABL plus basses, telles que MR4 (seuil de 0,01%), MR4,5 (seuil de 0,0032%) ou même MR5 (seuil de 0,001%).
On examine dans le cadre d’études cliniques s’il est possible d’arrêter complètement le traitement chez des patients présentant des valeurs BCR-ABL basses (au minimum MR4 ou MR4,5). Les études montrent que sans traitement, 50% de ces patients restent sans maladie. En médecine, on parle de rémission sans traitement (TFR pour Treatment Free Remission).
Effets secondaires
Tout médicament efficace peut aussi avoir des effets secondaires indésirables. Bien que les inhibiteurs des tyrosine kinases soient en général bien tolérés – et même mieux que les traitements qui les ont précédés – des effets indésirables peuvent survenir. La plupart de ces effets secondaires sont cependant peu sévères et peuvent être traités par des moyens simples. Il est important qu'en cas d'apparition d'effets secondaires, le médecin traitant en soit rapidement informé. Attention: le patient ne doit pas interrompre le traitement de son propre chef, car le bénéfice qu'il en tirerait pourrait en être réduit.
Les effets secondaires possibles sont:
- troubles gastro-intestinaux, tels que nausées et diarrhées
- œdèmes (rétention de liquide dans les tissus)
- fatigue, maux de tête
- crampes musculaires
- éruptions cutanées, démangeaisons
- diminution de la concentration des globules rouges, des globules blancs et des plaquettes sanguines dans le sang
Un entretien avec le médecin permettra de clarifier ce qui peut être entrepris contre ces effets secondaires. C’est lui qui, avec le patient, a la meilleure vue d’ensemble sur la maladie. Vous trouverez dans le chapitre «Vivre avec la LMC» des recommandations sur ce que le patient peut faire lui-même pour remédier à ces effets secondaires.
Greffe de cellules souches
Une greffe de cellules souches n'est envisageable en principe que dans deux cas de figure: chez des patients jeunes ou si les traitements médicamenteux n’agissent pas. La greffe peut amener la guérison de la LMC. Il existe cependant un risque considérable de devenir gravement malade ou de mourir pendant le traitement. C’est la raison pour laquelle, les patients atteints de LMC préfèrent être traités tout d’abord par des médicaments.
En principe, une greffe peut être réalisée durant toutes les phases de la LMC. Le taux de complications et donc la mortalité sont cependant accrus si la greffe est pratiquée pendant la phase d’accélération ou pendant la crise blastique. Dans l’allogreffe (ou greffe allogénique) de cellules souches, des cellules souches d’un donneur qui présente une bonne compatibilité génétique (marqueurs HLA) avec le receveur sont transférées à ce dernier.
Avant la greffe, les cellules souches malades du receveur doivent être détruites par l’administration d’une chimiothérapie fortement dosée. Durant cette phase – et jusqu’à plusieurs semaines après la greffe – il existe un risque considérable d’infection étant donné que le système immunitaire est très affaibli. De plus, il faut toujours craindre une réaction de rejet, en particulier lorsque les structures génétiques entre donneur et receveur ne sont pas idéalement compatibles. Ces réactions de rejet peuvent certes être généralement prévenues et combattues par l’administration de médicaments, mais la qualité de vie du patient en est souvent considérablement altérée et le traitement anti-rejet peut endommager des organes.
Médecine complémentaire
Il est fort compréhensible que des personnes souffrant de maladies chroniques souhaitent essayer des traitements, dits alternatifs, en complément d’un traitement anticancéreux classique considéré généralement comme strict et contraignant. Il est cependant essentiel de s’entretenir à ce sujet avec l’oncologue traitant car les produits «naturels» peuvent interagir avec les médicaments anticancéreux et éventuellement annuler l'effet bénéfique apporté par les anticancéreux. Important: faire part de ses besoins et souhaits au médecin même si l'on craint de ne pas être compris(e).
Désir d’enfant
S'il s’agit de patients LMC jeunes, un autre élément important doit être pris en considération dans le choix du traitement: les projets familiaux. Pendant le traitement médicamenteux – qui peut durer plusieurs mois – une contraception efficace est indispensable. En effet, les médicaments peuvent nuire considérablement à l’enfant en gestation dans le ventre maternel.
En cas de désir d’enfant, il est possible de prélever, avant le traitement, du sperme ou des ovules, en vue de leur conservation.
Si une patiente est enceinte lorsque le diagnostic de LMC est établi, ceci complique le traitement qui doit être conduit par un centre expérimenté.
Des études récentes montrent que lorsque la réponse au traitement est très bonne avec des valeurs BCR-ABL inférieures à 0,01% à long terme, il est possible d’arrêter le traitement ou tout au moins de l’interrompre pendant un certain temps. Cela ouvre de nouvelles perspectives quant à la possibilité d’une grossesse lors de LMC.
Liste de contrôle pour l’entretien avec le médecin traitant
Pour optimiser vos informations